
Ein genauer Anzeiger der alterung und Krankheit
Es wurde entdeckt, dass die Telomerverkürzung die primäre Ursache des menschlichen alterns und altersbedingter Krankheiten wie Krebs, Autoimmunität und Herzerkrankung ist. Die Analyse der Telomerlänge ist ein genauer Anzeiger des biologischen alters im Gegensatz zum chronologischen und ein wichtiger Durchbruch der Medizin in der Behandlung chronischer Krankheiten und der Steigerung der Langlebigkeit.
Telomere, DNA und Chromosomen
Die DNA ist der genetische Kode, der die Information für die Struktur und Funktion unseres Körpers enthält. Sie ist wie die Festplatte in einem Rechner, die die ganzen Informationen für die Programme enthält, die im Rechner laufen. Unsere DNA ist ein langer doppelspiraliger Strang, der in Form von Chromosomen verpackt ist. Es gibt 23 Chromosomenpaare in den menschlichen Zellen.
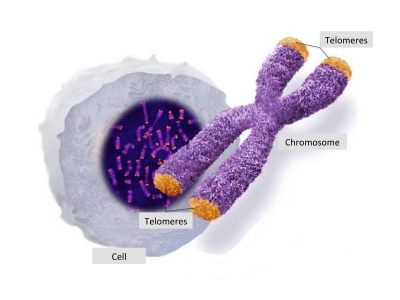
 Die Endteile der Chromosomen (die orangefarbigen Spitzen der Chromosomen im Bild oben) werden Telomere genannt. Ihr Name kommt aus dem griechischen „telos“ – was ‚Ende’ bedeutet – und „meros“ – was ‚Teil’ bedeutet – und sie sind buchstäblich das Endteil der Chromosomen. Die Enden der Telomere dienen dazu, die DNA zu schützen. Sie werden oft mit den Plastikschutzspitzen der Schnürsenkel verglichen, die einen Schnürsenkel vor dem Ausfransen schützen. Auf die gleiche Weise spielen die Telomere eine wichtige Rolle, um die DNA zu schützen und sie stabil zu halten.
Die Endteile der Chromosomen (die orangefarbigen Spitzen der Chromosomen im Bild oben) werden Telomere genannt. Ihr Name kommt aus dem griechischen „telos“ – was ‚Ende’ bedeutet – und „meros“ – was ‚Teil’ bedeutet – und sie sind buchstäblich das Endteil der Chromosomen. Die Enden der Telomere dienen dazu, die DNA zu schützen. Sie werden oft mit den Plastikschutzspitzen der Schnürsenkel verglichen, die einen Schnürsenkel vor dem Ausfransen schützen. Auf die gleiche Weise spielen die Telomere eine wichtige Rolle, um die DNA zu schützen und sie stabil zu halten.
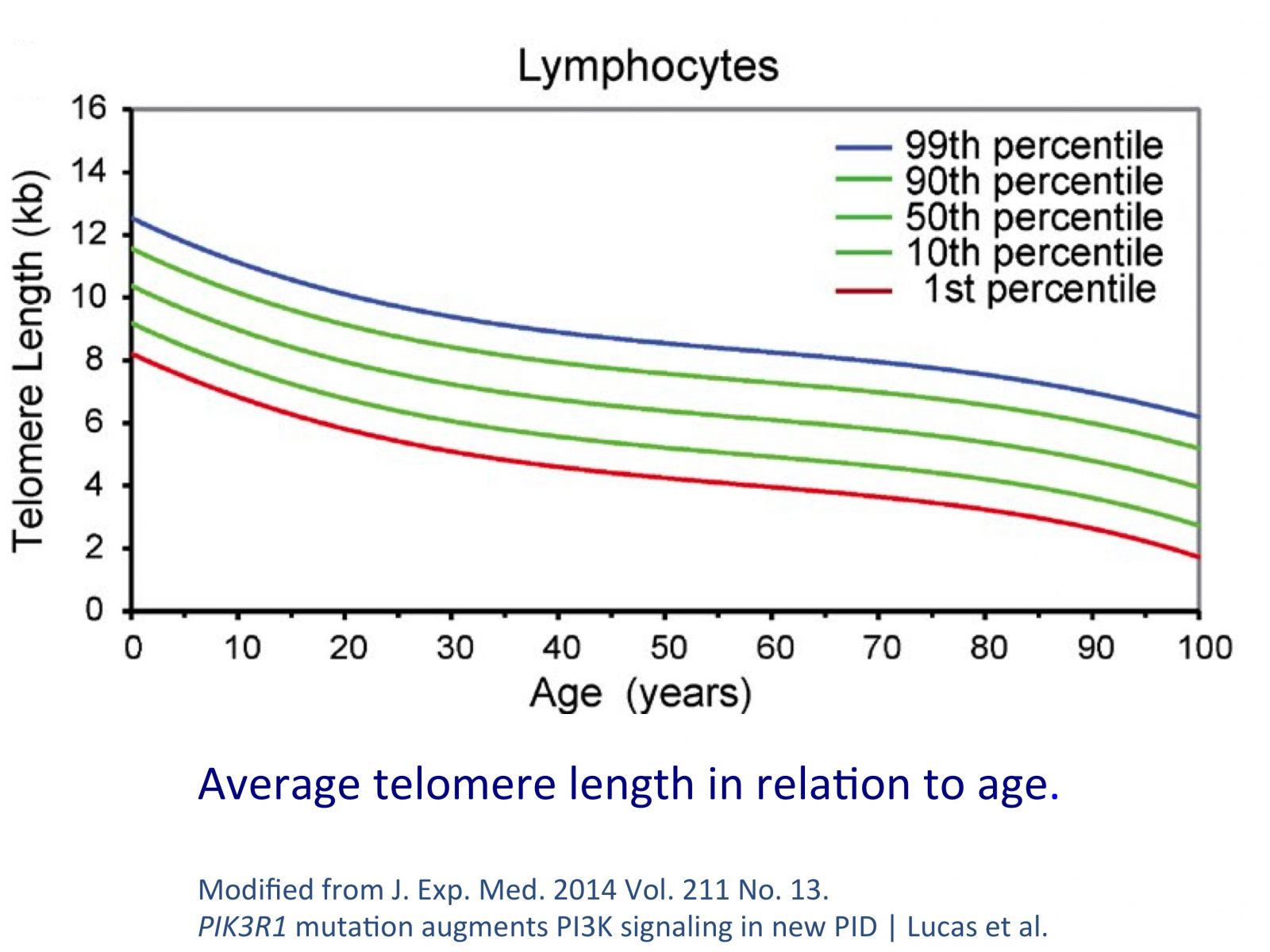
Bei der Empfängnis beginnen die menschlichen Zellen mit einer durchschnittlichen Telomer-Länge von 15.000 Basis-Paaren (Maßeinheit der Telomer-Länge, Abkürzung: bps). Während der embryonalen Periode verlieren wir einen großen Teil unserer Telomere aufgrund der hohen Reproduktionsrate der Zellen. Wir verlieren dann fast so viel Telomer-Länge, wie wir während unseres ganzen Lebens verlieren werden.
Bei der Geburt beträgt die durchschnittliche Telomer-Länge 10.000 bps. Im alter von 20 Jahren ist sie um die 8.000 bps. Wir verlieren weiter 35-150 Basis-Paare pro Jahr, bis wir eine Länge von weniger als 4.500 bps erreicht haben; dann werden die Chromosomen instabil und die Wahrscheinlichkeit für ernste Gesundheitsprobleme oder den Tod steigt exponentiell.
Mehr als der absolute Längenwert ist die Verlustrate das, was für unsere Gesundheit wichtig ist. Eine Person, die 35 statt 150 bps pro Jahr verliert, altert mit einem fünfmal langsameren Rhythmus. Es ist auch wichtig, an diesem Punkt zu erwähnen, dass unsere Zellen angeborene Mechanismen besitzen, die Telomere reparieren oder sogar wieder verlängern können.
Mehrere Faktoren aktivieren diese Mechanismen: Vitamine, Antioxydationsmittel, Diät, Omega-3-Fettsäuren, körperliche Übung und Nutrazeutika sind mit größerer Telomer-Länge und mit der Wiederverlängerung der Telomere in Verbindung gebracht worden.
Beziehung der Telomere zur Gesundheit und zu alterungskrankheiten
Wenn die Telomere nicht am Platz oder nicht lang genug wären, dann würden die Enden von verschiedenen Chromosomen zusammen verschmelzen, was eine Funktionsstörung oder den Tod der Zellen verursachen würde. Wenn Telomere tatsächlich zu kurz werden, verschmelzen die Chromosom-Enden von verschiedenen Chromosomen zusammen, was als das Startereignis der Krebsentstehung erkannt worden ist.
_svg.jpg) Während unseres Lebens werden unsere Telomere immer kürzer. Dies ist der Hauptgrund dafür, warum wir altern.
Während unseres Lebens werden unsere Telomere immer kürzer. Dies ist der Hauptgrund dafür, warum wir altern.
Mit jeder Zellteilung wird ein kleiner Teil unserer Telomere nicht kopiert, sodass sie stufenweise schrumpfen. Kürzere Telomere machen unsere DNA instabil und anfällig, und somit zeigt sie Krankheiten.
Je kürzer unsere Telomere sind, desto älter werden wir biologisch. Aber auch das Gegenteil ist wahr. Je länger unsere Telomere, desto biologisch jünger sind unsere Zellen und desto besser unsere Gesundheit.
Im Jahre 2009 wurde der Nobelpreis für Medizin drei Wissenschaftlern (E. Blackburn, C. Greider, J. Szosak) für ihre Arbeit in der Biologie der Telomere und in der Entdeckung der menschlichen alterungsmechanismen verliehen. In der Vergangenheit dachte man, dass die Ursache des alterns die Schadensanhäufung auf Zell- oder Organebene war. Man glaubte, dass Beschädigungen sich akkumulieren und dadurch unser Körper älter wird, so wie eine Maschine sich abnutzt. Allerdings erschien die Wahrheit im Hinblick auf die Entdeckungen der Telomer-Biologie eine andere zu sein.
Wir werden nicht wegen angesammelter Schäden auf Zellebene älter, sondern hauptsächlich weil das altern innerhalb unserer DNA vorprogrammiert ist. Angehäufte biologische Schäden veranlassen unsere Zellen, sich schneller zu reproduzieren, was unsere Telomere verkürzt, und dadurch altern wir und sterben. Die Abnutzung ist nicht die Ursache, sondern der Beschleunigungsfaktor im alterungsprozess. Das mag ähnlich klingen, aber in Wirklichkeit macht es einen großen Unterschied dahingehend, wie wir unsere Langlebigkeit und Gesundheit beeinflussen können.
Unseren Zellen steht eine beschränkte Anzahl von Teilungen in einem Leben zur Verfügung. Diese Zahl ist etwa 50 und wird durch die Länge unserer Telomere geregelt. Wir werden so mit einer begrenzten Anzahl von Zellteilungen, die uns zur Verfügung steht, geboren. Die Art, wie wir unser Leben führen, bestimmt, wie lange wir mit dieser Anzahl auskommen können.
Wenn wir Dinge tun, die unseren Zellen schaden – wie z.B. rauchen, nicht genug schlafen, schlechte Ernährungsgewohnheiten haben, an Vitaminmangel leiden, zu viel Alkohol trinken, Rauschgifte nehmen, übergewichtig sein, nicht körperlich üben, ein stressvolles Leben führen, sich dehydrieren lassen und sich Giftstoffen aussetzen – dann zwingen wir unsere Zellen, sich schneller zu teilen, damit sie das beschädigte Gewebe reparieren. Folglich altern wir früher. Tatsächlich stehen alle o.g. Faktoren mit erhöhtem Krankheitsauftreten und vorzeitigem Tod in Verbindung.
Biologisches gegen Chronologisches alter
 Je schneller sich unsere Zellen teilen, desto schneller schrumpfen unsere Telomere. Abhängig von der Schadenshöhe auf Zellebene gilt, je größer die Beschädigung, desto mehr Zellteilungen sind notwendig.
Je schneller sich unsere Zellen teilen, desto schneller schrumpfen unsere Telomere. Abhängig von der Schadenshöhe auf Zellebene gilt, je größer die Beschädigung, desto mehr Zellteilungen sind notwendig.
Es ist somit leicht nachvollziehbar, wie zwei Personen dasselbe chronologische alter haben, aber in einem vollkommen verschiedenen biologischen Zustand sein und ein anderes biologisches alter haben können.
Es wurde festgestellt, dass die Länge der Telomere ein genauer Anzeiger des biologischen gegenüber dem chronologischen alter einer Person ist. Je länger unsere Telomere sind, desto niedriger ist unser biologisches alter, während kürzere Telomere mit höherer Sterblichkeit und altersbedingten Krankheiten in Verbindung stehen.
Die Forschung behauptet, dass der Erhalt der Telomer-Länge die Möglichkeit bietet, alterungskrankheiten zu verhindern und zu behandeln, und möglicherweise den Menschen zu erlauben, ihre Lebensdauer über das gegenwärtige theoretische Maximum von 125 Jahren zu erhöhen.
Messung der Telomer-Länge
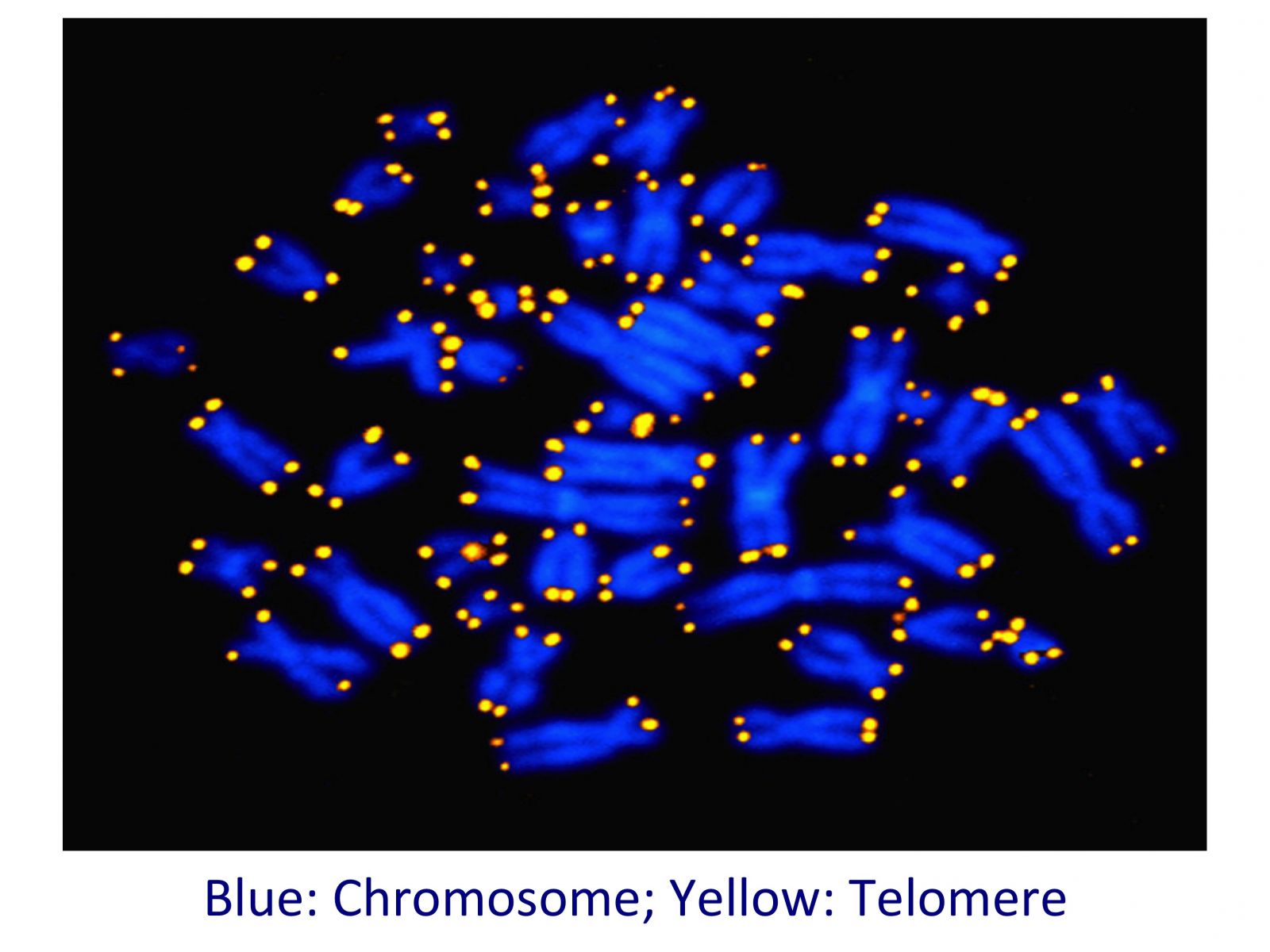 Unsere Zellen besitzen 23 Chromosomenpaare. Jedes Paar hat vier Telomere, d.h. insgesamt 92. Jedoch schrumpfen nicht alle Telomere mit derselben Geschwindigkeit. Einige davon verkürzen sich schneller als andere, sodass manche von unseren Telomeren lang sein können, während andere kurz sind.
Unsere Zellen besitzen 23 Chromosomenpaare. Jedes Paar hat vier Telomere, d.h. insgesamt 92. Jedoch schrumpfen nicht alle Telomere mit derselben Geschwindigkeit. Einige davon verkürzen sich schneller als andere, sodass manche von unseren Telomeren lang sein können, während andere kurz sind.
Die Telomer-Analyse, die nur die durchschnittliche Länge misst, bietet uns keine Daten über den Prozentsatz der langen – und, noch wichtiger, den Prozentsatz der kurzen – Telomere, die in unseren Chromosomen vorhanden sind.
Eine Person könnte eine gute Durchschnittslänge der Telomere haben, aber einen hohen Prozentsatz an kurzen Telomeren, die eine Messung der durchschnittlichen Länge nicht zeigen würden. Ihre DNA könnte dann, wegen der kürzeren Telomere, instabil werden und die Möglichkeit für chronische Krankheiten oder den Tod, sogar im Vorhandensein einer guten Durchschnittslänge der Telomere, erhöhen.
Der Prozentsatz der kurzen Telomere einer Person ist die wichtigste Angabe, um ihr biologisches alter und ihre Krankheitsneigung auszuwerten.
Es ist also lebenswichtig, nicht lediglich die durchschnittliche Länge, sondern auch die Länge jedes einzelnen der 92 Telomere separat zu messen. Dies kann mithilfe der sogenannten HT Q-FISH Methode (Hochdurchsatz-Quantitativ-Fluoreszent-vor Ort-Einkreuzung) erfolgen.
Unsere Klinik ist die einzige weltweit, die die HT-Q-FISH-Telomer-Analyse mit der metabolomischen Analyse und Behandlung kombiniert. Dies erlaubt die gleichzeitige Beurteilung sowohl der DNA als auch des Zustands der biochemischen Bahnen.
In unserer Klinik vermessen wir alle vier Telomere in jedem der 23 Chromosomenpaare, d.h. insgesamt 92 Telomere.
Wiederholte Messungen in einem Abstand von 6 Monaten oder einem Jahr offenbaren lebenswichtige Information über die Änderungsrate der kurzen Telomere, das Ansprechen auf eine Therapie und die Rezeptur für die weitere Behandlung.
Da der Prozentsatz der kurzen Telomere mit fast allen chronischen Krankheiten in Verbindung gebracht worden ist, kann seine Messung ein unschätzbares Werkzeug in den Händen eines Arztes sein, der individuell angepasste Medizin anwendet. Die Analyse der Telomer-Länge ist ein wichtiger Durchbruch der Medizin in der Behandlung chronischer Krankheiten und der Steigerung der Langlebigkeit.
Referenzen